Perguntas Frequentes sobre as Novas Terapias para Fibrose Cística
Instituto Unidos pela Vida - 08/01/2020 15:45Por: Verônica Stasiak Bednarczuk, psicóloga, diagnosticada com Fibrose Cística aos 23 anos. Fundadora e diretora geral do Unidos pela Vida – Instituto Brasileiro de Atenção à Fibrose Cística, membro do Grupo Brasileiro de Estudos em Fibrose Cística (GBEFC), coordenadora do GT de Associações do GBEFC;
Nota importante: As informações aqui contidas tem cunho estritamente educacional. Em hipótese alguma pretendem substituir a consulta médica, a realização de exames e ou, o tratamento médico. Em caso de dúvidas fale com seu médico, ele poderá esclarecer todas as suas perguntas.
 Quem tem ou convive com Fibrose Cística já deve ter ouvido falar, pelo menos uma vez, sobre as “novas terapias”. Mas o que são, o que fazem e quando estarão disponíveis no Brasil?
Quem tem ou convive com Fibrose Cística já deve ter ouvido falar, pelo menos uma vez, sobre as “novas terapias”. Mas o que são, o que fazem e quando estarão disponíveis no Brasil?
Antes de mais nada, é importante reforçar que somente um médico poderá prescrever estas novas terapias ou qualquer outro medicamento (para FC ou para qualquer outra doença). Ninguém deve se automedicar, nem tão pouco “copiar” o tratamento de outra pessoa. Cada um é cada um, e somente o médico e a equipe de saúde poderão orientar acerca do tratamento e dizer para quem estas novas drogas são indicadas. Neste material, reunimos dados que estão disponíveis na internet, nos sites oficiais das novas terapias, nos comunicados oficiais do FDA (Food and Drug Administration), da Anvisa, dentre outros, e você pode conferir a lista completa de referências ao final deste texto.
Relembrando o processo de aprovação e registro de um novo medicamento:
Todo medicamento que vai ser lançado no mercado passa por diversas etapas de pesquisa e testes até ser aprovado pelo órgão competente do país de origem do fabricante. Você pode relembrar passo a passo deste processo lendo este texto: “Como um novo medicamento é desenvolvido e testado?”¹
Na hipótese do medicamento ser produzido em outro país, por exemplo nos EUA, ele primeiro precisa ser aprovado pelo FDA² (Food and Drug Administration – que é a agência regulatória americana) e ao chegar no Brasil, ele precisará ser aprovado e registrado pela Agência Nacional de Vigilância Sanitária (Anvisa³). Porém, o processo não é “automático”. A indústria fabricante precisa criar um documento tecnicamente embasado e enviar à Anvisa pedindo o registro do medicamento. O Kalydeco®, por exemplo, foi aprovado pelo FDA em 2012 e pela Anvisa em 2018. Já o Orkambi® recebeu aprovação do FDA em 2015 e da Anvisa em 2018.
O que é o Registro na Anvisa – Agência Nacional de Vigilância Sanitária?
A Anvisa é o órgão responsável no Brasil por registrar novos medicamentos, entre outros. Segundo ela, medicamento é todo produto farmacêutico, tecnicamente obtido ou elaborado, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico. Assim, qualquer produto, independentemente da natureza (vegetal, animal, mineral ou sintética) que possuir alegações terapêuticas, deve ser considerado medicamento e precisa de registro para ser fabricado e comercializado.
E quanto tempo leva para sair um pedido de registro?
De acordo com a Lei 13411/2016 4 que estabelece prazo para análise de processo de registro de medicamento, o pedido de registro deveria ser avaliado da seguinte forma:
I – para a categoria prioritária (onde entram os medicamentos para doenças raras, por exemplo), de cento e vinte dias e de sessenta dias, contados a partir da data do respectivo protocolo de priorização;
II – para a categoria ordinária, de trezentos e sessenta e cinco dias e de cento e oitenta dias, contados a partir da data do respectivo protocolo de registro ou de alteração pós-registro.
Para entender melhor sobre o Registro na Anvisa, clique aqui e leia o texto detalhado que preparamos: https://unidospelavida.org.br/aprovacao-medicamentos/
Para o registro de novos medicamentos para tratamento, diagnóstico ou prevenção de doenças raras, em 2017 a Anvisa publicou a Resolução da Diretoria Colegiada (RDC) 205, que estimula o registro de produtos nacionais, de forma mais rápida, desde que a documentação esteja completa e não haja solicitação de registro em outro país. No caso de medicamentos produzidos fora do Brasil, a solicitação de reunião de pré-submissão à Anvisa deve ser realizada em até 60 dias após o primeiro pedido de registro em outra autoridade reguladora. Isso significa que a empresa poderá submeter o registro, ao mesmo tempo, em vários países.
Para a Anvisa, esse trâmite traz interesse das empresas internacionais em solicitar o registro no Brasil concomitantemente ao pedido feito em outras grandes agências reguladoras, o que representa maior possibilidade de acesso dos pacientes brasileiros ao medicamento.
Se o medicamento já foi registrado em outros países, o laboratório deve apresentar relatório técnico de avaliação do produto, emitido pelas respectivas autoridades reguladoras, quando disponível. Isso representa economia de tempo no processo de registro.
No caso de medicamentos importados, é permitida a supressão do controle de qualidade no Brasil, desde que seja realizado e comprovado pelo fabricante. A Anvisa também permite a apresentação de complementação de dados e provas adicionais, posteriormente à concessão do registro, por meio de assinatura de termo de compromisso entre o órgão e a empresa solicitante. O não cumprimento do termo pode levar ao cancelamento do registro.
E o que são as “novas terapias”?
As terapias baseadas nos moduladores da CFTR (proteína reguladora do canal que atravessa a membrana celular) corrigem a proteína defeituosa produzida pelo gene CFTR na Fibrose Cística.
Uma vez que diferentes mutações causam defeitos diversos na proteína, os medicamentos desenvolvidos até o momento são eficazes apenas para pessoas com mutações específicas, ou seja, as novas terapias não são indicadas para todos. Depende da mutação que o paciente tem, bem como da idade que ele está. Abaixo você poderá conferir detalhadamente estas informações.
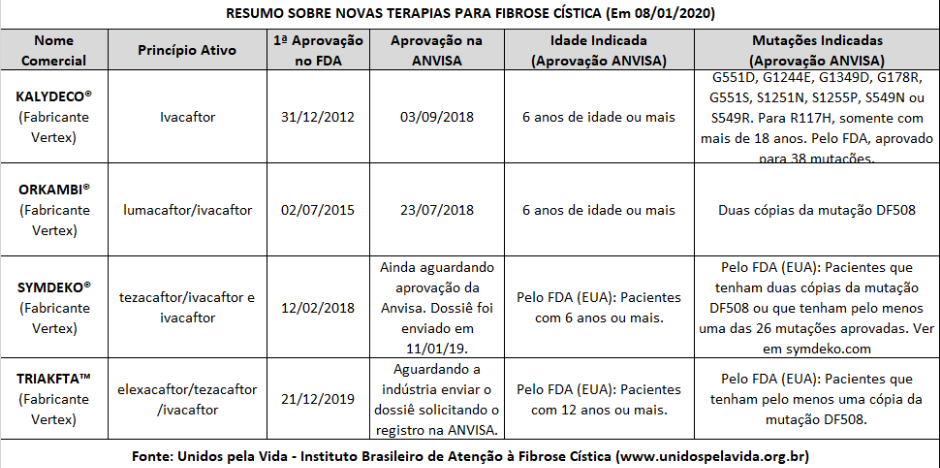
Hoje, há quatro moduladores da CFTR para pessoas com determinadas mutações CFTR: Kalydeco® (ivacaftor), Orkambi® (lumacaftor/ivacaftor), Symdeko® (tezacaftor/ivacaftor e ivacaftor) e Trikafta™ (elexacaftor/tezacaftor/ivacaftor).
A proteína CFTR controla o fluxo adequado de água e cloreto para dentro e fora das células que revestem os pulmões e outros órgãos. Em pessoas com FC, as mutações no gene CFTR causam a produção de uma proteína defeituosa ou na ausência de produção tal situação leva ao acúmulo de muco espesso e viscoso, que pode acarretar infecções nos pulmões, lesões no pâncreas e problemas em outros órgãos do corpo.
Uma vez que esses medicamentos são voltados a pessoas com mutações específicas da FC, eles não funcionarão caso você não tenha uma ou mais dessas mutações. A primeira coisa a fazer para saber se estas terapias vão funcionar no seu caso, é descobrir quais são as suas mutações Converse com sua equipe de saúde sobre a possibilidade de realizar o exame genético.
Quais são e qual a situação no Brasil destas novas terapias?
1) KALYDECO® (ivacaftor) – Site oficial: https://www.kalydeco.com/
Data da 1ª Aprovação no FDA: 31/01/2012
Data de Aprovação na ANVISA: 03/09/2018
Aprovação na Anvisa (Brasil): KALYDECO® (ivacaftor) é indicado para o tratamento de fibrose cística (FC) em pacientes com 6 anos de idade ou mais, pesando 25 kg ou mais e que apresentam uma das seguintes mutações de gating (classe III) no gene regulador da condutância transmembrana da fibrose cística (CFTR): G551D, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N ou S549R. KALYDECO® também é indicado para o tratamento de FC em pacientes com 18 anos de idade ou mais que apresentam uma mutação R117H (que possui defeitos de gating e condutância). Portadores da mutação DeltaF508 não são elegíveis. Nos EUA, outras 38 mutações já foram aprovadas.
Status atual no SUS: Ainda não disponível no SUS. A fabricante Vertex enviou o dossiê solicitando a análise da Comissão Nacional de Incorporação de Tecnologias no Sistema Único de Saúde – Conitec em 17 de Dezembro de 2019. A Conitec tem 180 dias para avaliar, prorrogáveis por mais 90 dias. Após, a Conitec publicará em seu site dois Relatórios de Recomendação (um para a sociedade e um científico), constando recomendação favorável ou não à incorporação. Com a publicação do Relatório, abre-se também a consulta pública onde todos (profissionais, familiares, pacientes, etc) poderão participar, durante 20 dias, informando suas condições e se concordam ou não com o que foi recomendado. Nesta fase, nós iremos informar exatamente como funciona e como participar. No momento, a Conitec está dentro do prazo de avaliação.
2) ORKAMBI® (lumacaftor/ivacaftor) – Site Oficial: https://www.orkambi.com/
Data da 1ª Aprovação no FDA: 02/07/2015
Data de Aprovação na ANVISA: 23/07/2018
Aprovação na Anvisa (Brasil): ORKAMBI® (lumacaftor/ivacaftor) é indicado para o tratamento de fibrose cística (FC) em pacientes com 6 anos de idade ou mais e que são homozigotos para a mutação F508del no gene regulador de condutância transmembrana da fibrose cística (CFTR), ou seja: que tenham duas cópias da mutação DF508.
Para quem já está aprovado no FDA (nos EUA)? Pacientes com 2 anos ou mais, que tenham duas cópias da mutação DF508.
Status atual no SUS: Também ainda não está disponível no SUS, e, assim como o Kalydeco®, a fabricante Vertex enviou o dossiê solicitando a análise da Conitec em 17 de Dezembro de 2019. A Conitec tem 180 dias para avaliar, prorrogáveis por mais 90 dias.
3) SYMDEKO® (tezacaftor/ivacaftor and ivacaftor) – Site Oficial : symdeko.com
Data da 1ª Aprovação no FDA: 12/02/2018
Data de Aprovação na ANVISA: 27/01/2020
Para quem já está aprovado no FDA (nos EUA)? Pacientes com 6 anos ou mais, que tenham duas cópias da mutação DF508 ou que tenham pelo menos uma das 26 mutações abaixo:
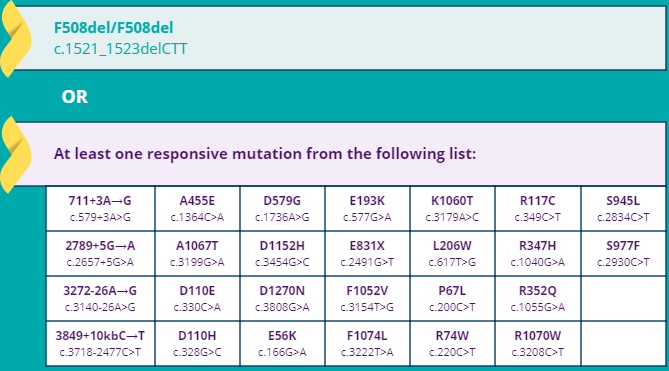
Fonte: www.symdeko.com
Status atual no SUS: Ainda precisa receber a aprovação da Anvisa e, após, poderá ser enviado o dossiê para a Conitec avaliar (fase em que encontram-se as medicações Kalydeco® e Orkambi®).
4) TRIKAFTA™ (elexacaftor/tezacaftor/ivacaftor) – Site Oficial: trikafta.com
Data da 1ª Aprovação no FDA: 21/10/2019
Data de Aprovação na ANVISA: O Trikafta™ ainda não foi submetido para registro na Anvisa, ou seja, ele ainda não está passando pelo processo de aprovação no Brasil. Neste momento, a comunidade brasileira está empenhada em uma campanha chamada #RegistraVertex, pedindo para que a indústria fabricante peça o registro do medicamento no Brasil com brevidade. Não há previsão de quando a indústria irá solicitar este pedido no Brasil.
Para quem já está aprovado no FDA (nos EUA)? TRIKAFTA™ está indicado para pacientes com 12 anos ou mais que tenham pelo menos uma cópia da mutação DF508.
E QUAL O PROPÓSITO DA CAMPANHA #REGISTRAVERTEX?
Através dela, o Unidos pela Vida – Instituto Brasileiro de Atenção à Fibrose Cística, a ABRAM – Associação Brasileira de Assistência à Mucoviscidose, e o GBEFC – Grupo Brasileiro de Estudos em Fibrose Cística estão pleiteando, em nome das pessoas com Fibrose Cística, familiares, pacientes, associações e profissionais, que a fabricante Vertex solicite o registro do Trikafta no Brasil, junto à Anvisa, para que este processo não seja tão demorando quanto infelizmente foram outros, e que, com brevidade, os pacientes do Brasil possam acessar esta medicação e usufruir da melhora na qualidade de vida, já comprovada cientificamente.
QUADRO RESUMO:
Referências:
1) https://unidospelavida.org.br/como-um-novo-medicamento-e-desenvolvido-e-testado/
2) https://www.fda.gov/
3) http://www.anvisa.gov.br/
4) http://www.planalto.gov.br/ccivil_03/_Ato2015-2018/2016/Lei/L13411.htm
5) https://unidospelavida.org.br/moduladores-cftr/
6) https://www.kalydeco.com/
7) https://www.drugs.com/history/kalydeco.html
8) https://consultas.anvisa.gov.br/#/medicamentos/25351656612201759/?nomeProduto=kalydeco
9) https://unidospelavida.org.br/kalydecoaprovadoanvisa/
10) http://conitec.gov.br/entenda-a-conitec-2
11) https://orkambi.com
12) https://www.drugs.com/history/orkambi.html
13) https://bit.ly/diario-oficial-orkambi
14) https://consultas.anvisa.gov.br/#/medicamentos/25351621721201755/
15) https://www.accessdata.fda.gov/drugsatfda_docs/nda/2018/211358Orig1s000Approv.pdf
16) https://www.symdeko.com/
17) https://www.drugs.com/history/symdeko.html
18) https://www.symdeko.com/
19) https://www.trikafta.com/
20) https://www.trikafta.com/
Complementares:
- Trikafta™ Approval: Community Frequently Asked Questions – https://www.cff.org/Life-With-CF/Treatments-and-Therapies/Trikafta-Approval-Community-FAQ/
- FDA approves new breakthrough therapy for cystic fibrosis – https://www.fda.gov/news-events/press-announcements/fda-approves-new-breakthrough-therapy-cystic-fibrosis
- Diário Oficial da União – http://pesquisa.in.gov.br/imprensa/jsp/visualiza/index.jsp?data=23/07/2018&jornal=531&pagina=51
- Orkambi é aprovado pela Anvisa – https://unidospelavida.org.br/orkambi-e-aprovado-pela-anvisa/
- Portal Vertex Global – https://www.vrtx.com/


