FDA expande o uso de modulador para tratar outras mutações residuais da Fibrose Cística
Instituto Unidos pela Vida - 03/08/2017 12:52A Vertex Pharmaceuticals Incorporated anunciou no dia 01 de agosto que a US Food and Drug Administration (FDA) aprovou o Ivacaftor para uso em mais de 600 pessoas com Fibrose Cística (FC), de 2 anos ou mais, que possuem uma das cinco mutações de função residual que resultam em um defeito no gene regulador de condutância transmembranar da Fibrose Cística (CFTR).
Esta aprovação baseou-se em dados clínicos de Fase 3 do Ivacaftor nestas mutações e segue a aprovação da FDA para Ivacaftor , em maio de 2017, para outras 23 mutações de função residual, que se basearam em análises de casos in vitro. Ambas as aprovações são resultado de mais de cinco anos de experiência clínica do mundo real que demonstram o perfil estabelecido de segurança e eficácia da Ivacaftor .
“Nos cinco anos desde que o Ivacaftor se tornou o primeiro medicamento aprovado para tratar a causa subjacente da Fibrose Cística, fomos implacáveis em nossos esforços para trazer este importante remédio para todos os que podem se beneficiar”, disse Jeffrey Chodakewitz, vice-presidente executivo e Diretor Médico da Vertex. “Continuaremos a prosseguir este objetivo até que todas as pessoas com FC tenham um medicamento que trate a sua forma desta doença grave”.
A FC é causada por proteínas de regulador de condutância transmembranar (CFTR) falidas ou faltantes de fibrose cística resultantes de mutações no gene CFTR. As proteínas defeituosas ou faltantes resultam em fraco fluxo de sal (sódio e cloreto) e água dentro ou fora das células em vários órgãos, incluindo os pulmões. As cinco mutações abrangidas pela aprovação de hoje (2789 + 5G-> A, 3272-26A-> G, 3849 + 10kbC-> T, 711 + 3A-> G e E831X) causam FC e resultam em uma perda moderada de transporte de cloreto. As pessoas que apresentam essas mutações geralmente experimentam declínio progressivo da função pulmonar e outras complicações da doença. As cinco dessas mutações foram avaliadas como parte do estudo de Fase 3 EXPAND, previamente divulgado, no qual o braço de monoterapia com Ivacaftor atingiu seu ponto final de eficácia primário e foi geralmente bem tolerado.
Ivacaftor agora está aprovado nos EUA para tratar pessoas com idades de mais de 2 anos que possuem uma das 38 mutações sensíveis ao ivacaftor no gene CFTR.
Confira a relação de mutações: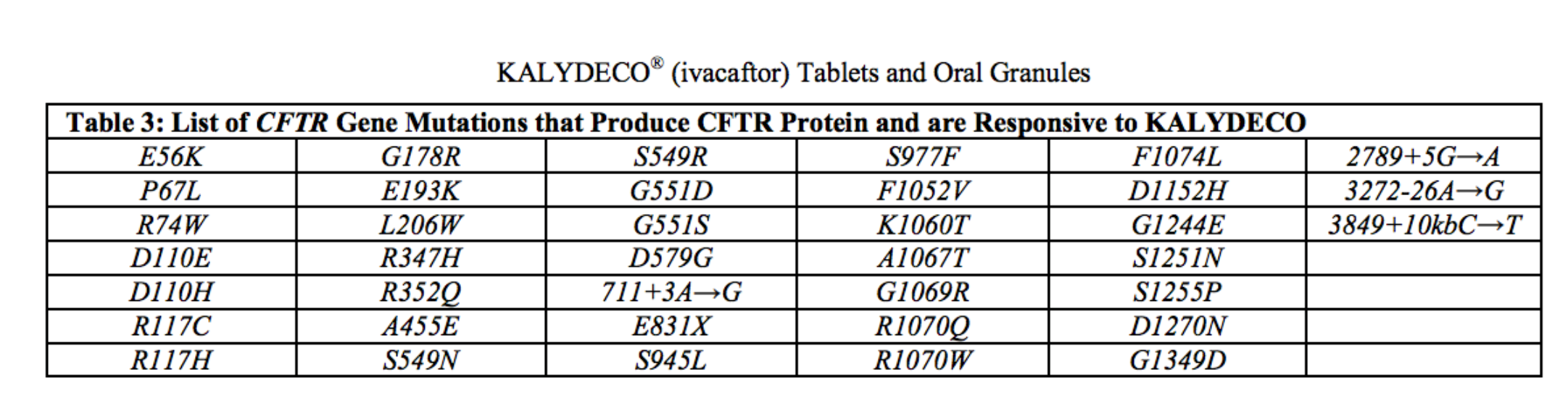
FONTE: https://www.streetinsider.com/Corporate+News/Vertex+Pharma+%28VRTX%29+KALYDECO+Approved+for+CF+Patients+With+Certain+Residual+Function+Mutations/13151555.html
—
Nota importante: As informações aqui contidas tem cunho estritamente educacional. Em hipótese alguma pretendem substituir a consulta médica, a realização de exames e ou, o tratamento médico. Em caso de dúvidas fale com seu médico, ele poderá esclarecer todas as suas perguntas.


