Primeiro mapa estrutural da proteína da fibrose cística pode revelar como mutações causam a doença
Instituto Unidos pela Vida - 19/12/2016 16:30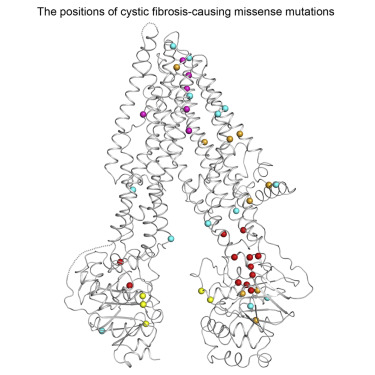 Nota importante: As informações deste texto têm cunho estritamente educacional. Em hipótese alguma pretendem substituir a consulta médica, a realização de exames e ou, o tratamento médico. Em caso de dúvidas fale com sua equipe multidisciplinar, eles poderão esclarecer todas as suas perguntas!
Nota importante: As informações deste texto têm cunho estritamente educacional. Em hipótese alguma pretendem substituir a consulta médica, a realização de exames e ou, o tratamento médico. Em caso de dúvidas fale com sua equipe multidisciplinar, eles poderão esclarecer todas as suas perguntas!
Os cientistas da Universidade de Rockefeller criaram o primeiro mapa tridimensional da proteína responsável pela fibrose cística, uma doença hereditária para a qual ainda não há cura. Esta descoberta, descrita na edição do dia 1 de dezembro no jornal americano Cell, oferece os tipos de insights essenciais para uma melhor compreensão e tratamento desta doença. A Fibrose Cística obstrui os pulmões com um muco pegajoso, levando a problemas respiratórios e/ou infecções respiratórias.
“Com essa estrutura tridimensional, a qual nós resolvemos até o nível atômico, podemos dizer mais sobre como a proteína fibrose cística funciona normalmente e visualizar como ela se torna alterada em pacientes”, diz o autor Jue Chen, Professor William E. Ford e Chefe do Laboratório de Biologia de Membrana e Biofísica.
Chen e o primeiro autor Zhe Zhang, um pós-doutorando em seu laboratório, traçaram as localizações das mutações causadoras de doenças dentro da estrutura e revelaram um ponto vulnerável na proteína que parece ser responsável por muitos casos da doença. “Ao examinar o que está errado aqui e em outros esperamos que seja possível desenvolver tratamentos que corrijam esses erros”, diz Zhang.
Moléculas no gelo
A proteína em questão, o regulador de condutância transmembranar de fibrose cística (CFTR), forma um canal na superfície das células que permite que partículas de cloro, um componente de sal, passem através da membrana celular. Visto que a distribuição do sal afeta o movimento da água, uma interrupção ao canal desidrata o muco que cobre determinados órgãos – incluindo os pulmões, onde o acúmulo do muco grosso pode permitir que as bactérias cresçam e potencialmente levar às complicações com risco de vida.
Até agora, os cientistas identificaram milhares de mutações no gene CFTR que podem causar esta doença. Contudo, não ficou totalmente claro como esses erros interferem com o canal, uma vez que os pesquisadores não conseguiam determinar sua estrutura.
O principal problema foi que o CFTR resistiu aos esforços dos cientistas para transformá-lo em cristais – um passo essencial no método padrão para determinar a estrutura de uma molécula. Então, em vez disso, Chen e Zhang usaram uma técnica avançada conhecida como microscopia crioeletrônica, na qual as moléculas são congeladas no gelo sem necessidade de serem transformadas em cristais.
Com equipamentos de última geração instalados no Centro de Recursos de Microscopia Crioeletrônica Evelyn Gruss Lipper em 2014, Chen e Zhang tiraram fotos de quase um milhão de moléculas CFTR congeladas em uma fina camada de gelo. Ao compilar as fotos bidimensionais, eles criaram a primeira estrutura tridimensional completa da proteína da fibrose cística.
Abrindo a porta
Dentro da estrutura, que se assemelha a um prendedor de roupa embutido dentro da membrana plasmática da célula, os pesquisadores tiveram um deslumbre no mecanismo pelo qual o canal abre e fecha. Estes incluíram o primeiro vislumbre de uma porção misteriosa de CFTR, conhecida como o domínio R. Ele fica entre os “braços do prendedor de roupa”, mantendo o canal fechado, impedindo o movimento normal.
“Ter esse primeiro vislumbre de toda a molécula parecia um privilégio”, diz David Gadsby, Professor Patrick A. Gerschel na Rockefeller e chefe do Laboratório de Fisiologia Cardíaca e de Membrana. Gadsby, que estuda a proteína CFTR há 25 anos, não estava diretamente envolvido na determinação da estrutura, mas ajudou Chen e Zhang a interpretar suas descobertas. “Foi fantástico”, diz ele. “Era como se a mãe natureza tivesse finalmente aberto uma porta que tinha sido fechada por muito tempo.”
Mapeando mutações
Dentro da nova estrutura, Zhang e Chen identificaram 46 locais que são alterados por mutações que causam doenças. Uma tendência surpreendente surgiu dos dados: Uma metade do canal possui muito mais desses erros do que o outro, sendo responsável por 70% dos casos de doença. Uma inspeção do mapa revelou que esta parte da proteína contém uma articulação fraca mais vulnerável à ruptura.
“Pensamos que este é um bom lugar para começar a procurar maneiras de tratar a fibrose cística na sua fonte”, diz Chen, que também é um investigador do Instituto Médico Howard Hughes. “Se eu fosse um bioquímico desenvolvendo drogas, eu procuraria algo que pudesse agir um pouco como cola para fortalecer esse ponto fraco dentro da proteína”.
Artigo “Atomic Structure of the Cystic Fibrosis Transmembrane Conductance Regulator” – http://www.cell.com/cell/abstract/S0092-8674(16)31535-5
Traduzido por Thiago Arzua: Estudante de Medicina na University of South Florida, em Tampa nos EUA. Voluntário também em um laboratório de neurobiologia, com ênfase em doenças neurodegenerativas como Alzheimer’s. Foi assistente de pesquisador em um laboratório de química sintética por mais de um ano, incluindo contribuições em artigos publicados e diversas conferências nos EUA. Em março de 2014, foi ao Peru em uma missão para ajudar comunidades carentes com programas educacionais e clínicas gratuitas. Quando no Brasil, atua como voluntário no Hospital das Clínicas de Curitiba e no Hospital do Trabalhador.


