Symdeko é aprovado pela Anvisa
Comunicação IUPV - 27/01/2020 10:51 No dia 27 de janeiro de 2020, foi publicado no Diário Oficial da União a aprovação do medicamento Symdeko na Agência Nacional de Vigilância Sanitária (ANVISA). O dossiê para avaliação foi enviado em 11 de janeiro de 2019, e após muita espera, finalmente a aprovação foi realizada.
No dia 27 de janeiro de 2020, foi publicado no Diário Oficial da União a aprovação do medicamento Symdeko na Agência Nacional de Vigilância Sanitária (ANVISA). O dossiê para avaliação foi enviado em 11 de janeiro de 2019, e após muita espera, finalmente a aprovação foi realizada.
A aprovação do Symdeko não significa que ele estará disponível pelo Sistema Único de Saúde (SUS) imediatamente. Com a aprovação, o próximo passo é a discussão em relação ao seu preço na Câmara de Regulação do Mercado de Medicamentos (CMED) e, então, a batalha pela incorporação no SUS será iniciada. O trabalho executivo da CMED também é realizado pela Anvisa.
Sobre o Symdeko
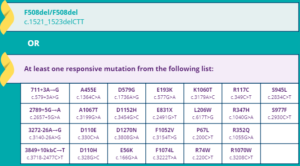
Aprovado pela Food and Drug Administration (FDA) em fevereiro de 2018, o Symdeko pode ser utilizado por pacientes com 12 anos ou mais, que tenham duas cópias da mutação DF508 ou que tenham pelo menos uma das 26 mutações abaixo:
O Symdeko combina dois agentes ativos, VX-661 (tezacaftor) e ivacaftor para ajudar a melhorar o desempenho do canal CFTR em pacientes com Fibrose Cística. O VX-661 ajuda a proteína CFTR a se deslocar para a superfície celular, onde o ivacaftor ajuda o canal iônico CFTR a permanecer aberto por períodos mais longos. A ação combinada dos dois medicamentos melhora o equilíbrio de água e sais nos órgãos afetados, incluindo os pulmões.
Atenção: o medicamento Trikafta, da campanha #RegistraVertex, ainda não foi submetido para registro na ANVISA, ou seja, ele ainda não está passando pelo processo de aprovação no Brasil.
Nota importante: As informações aqui contidas tem cunho estritamente educacional. Em hipótese alguma pretendem substituir a consulta médica, a realização de exames e ou, o tratamento médico. Em caso de dúvidas fale com seu médico, ele poderá esclarecer todas as suas perguntas.


