Por dentro do processo: atualizações sobre os novos medicamentos para fibrose cística
Comunicação IUPV - 01/10/2020 08:02Graças aos avanços da Medicina, novos medicamentos e tecnologias surgem todos os dias com o objetivo de melhorar a saúde e também a qualidade de vida de pessoas diagnosticadas com as mais diversas doenças em todo o mundo. E no cenário da fibrose cística não é diferente. Nos últimos anos, terapias foram desenvolvidas e trouxeram novas perspectivas para o tratamento da doença.
Ao redor do mundo, pessoas com fibrose cística relatam a melhora que esses medicamentos estão trazendo para suas vidas, o que causa muita expectativa entre a comunidade da fibrose cística no Brasil. Por conta disso, , todos os dias recebemos perguntas sobre como está o processo de incorporação de cada um destes medicamentos em nosso país.
Para sanar estas dúvidas e relembrar os processos, preparamos este material com as últimas atualizações sobre cada um destes medicamentos. Este texto foi publicado em nosso site no dia 01 de outubro de 2020 e atualizações podem ter sido realizadas até a data em que você está fazendo a leitura deste material. Por isso, em caso de dúvidas, entre em contato conosco pelo e-mail [email protected] ou pelo WhatsApp (41) 99636-9493.
Kalydeco (Ivacaftor) e Orkambi (Lumacaftor/Ivacaftor)

No dia 12 de agosto de 2020 foram abertas as consultas públicas referentes aos medicamentos Kalydeco e Orkambi no site da Comissão Nacional de Incorporação de Tecnologias no SUS (Conitec). As consultas foram iniciadas após a recomendação inicial desfavorável à incorporação realizada durante a 88º Reunião da Conitec e se encerraram no dia 31 de Agosto de 2020.
E agora você deve estar se perguntando: em quanto tempo teremos o resultado e saberemos se as recomendações iniciais desfavoráveis foram revertidas? A Conitec tem o prazo de 180 dias para fazer a avaliação do medicamento e esse período começa a contar a partir da data do protocolo de solicitação do pedido (no caso do Kalydeco e Orkambi, feito em 17 de dezembro de 2019). Esse prazo pode ser prorrogado por mais 90 dias, quando, de acordo com a Conitec, as circunstâncias exigirem. Nesse período, está incluído o tempo de consulta pública e todas as etapas da análise do processo.
Assim que obtivermos novas informações sobre o resultado das consultas públicas, divulgaremos no site e mídias sociais do Unidos pela Vida. Lembramos que o pedido de incorporação de Kalydeco (ivacaftor) foi realizado com indicação para pessoas com fibrose cística acima de 6 anos que apresentem uma das seguintes mutações de gating (classe III), G55ID, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N ou S549R. Já o Orkambi (lumacaftor/ivacaftor), foi solicitada a incorporação com indicação para pacientes com 6 anos de idade ou mais e que são homozigotos para a mutação Delta F508 no gene regulador de condutância transmembrana da fibrose cística (CFTR), ou seja, que tenham duas cópias da mutação Delta F508.
Trikafta (elexacaftor/tezacaftor/ivacaftor)
O Trikafta, medicamento que tem sido descrito com uma terapia que pode mudar a realidade das pessoas com fibrose cística, foi aprovado nos Estados Unidos em outubro de 2019 para pessoas com fibrose cística que tenham mais de 12 anos e pelo menos uma mutação Delta F508.. No Brasil, após a campanha #RegistraVertex, que solicitou que a indústria faça o pedido de registro do medicamento na Agência Nacional de Vigilância Sanitária (ANVISA), a empresa Vertex Pharmaceuticals, fabricante deste medicamento anunciou que fará o pedido do registro do medicamento Trikafta junto à ANVISA no Brasil no primeiro trimestre de 2021, destacando que o pedido já será jeito para pacientes acima de seis anos. Clique aqui para conferir a nota sobre o anúncio na íntegra.
Symdeko (tezacaftor/ivacaftor e ivacaftor)
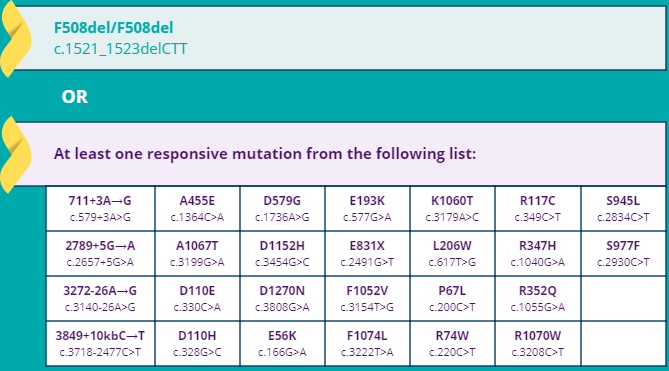
O medicamento Symdeko está aprovado no Food and Drug Administration (FDA) para pessoas diagnosticadas com fibrose cística com 12 anos ou mais, que tenham duas cópias da mutação DF508 ou que tenham pelo menos uma das 26 mutações abaixo.
O medicamento Symdeko foi aprovado pela FDA nos EUA no dia 12 de fevereiro de 2018. Em 11 de janeiro de 2019, a Vertex Pharmaceuticals solicitou o registro do medicamento à ANVISA, e a aprovação pela agência veio no dia 27 de janeiro de 2020.
Em julho de 2020, a Câmara de Regulação do Mercado de Medicamentos (CMED) publicou em sua lista de preços o Symdeko, tornando o medicamento apto para comercialização no Brasil. Esta aprovação do preço do Symdeko é importante porque permite que o Laboratório Vertex Pharmaceuticals peça formalmente à Conitec a avaliação para incorporação desta medicação ao Sistema Único de Saúde (SUS).
Continue acompanhando o site e as mídias sociais do Unidos pela Vida para se manter atualizado sobre o andamento do processo de registro incorporação de cada um destes medicamentos.
Referências:
http://conitec.gov.br/index.php/consultas-publicas-2020-encerradas
Nota importante: As informações aqui contidas tem cunho estritamente educacional. Em hipótese alguma pretendem substituir a consulta médica, a realização de exames e ou, o tratamento médico. Em caso de dúvidas fale com seu médico, ele poderá esclarecer todas as suas perguntas.


